Investigadores del CIBER-BBN en el Instituto de Investigación Biomédica de Sant Pau (IIB Sant Pau), la Universitat Autònoma de Barcelona (UAB) y el CSIC han demostrado la eficacia de un nanofármaco, creado por los propios investigadores, que elimina selectivamente las células madre metastásicas en modelos animales de cáncer de colon. Estos resultados han sido publicados en una de las revistas científicas internacionales más prestigiosas en el ámbito de la Medicina Molecular, EMBO Molecular Medicine.
El equipo de investigadores, liderados por Ramon Mangues, del l’IIB Sant Pau, Toni Villaverde y Esther Vázquez, de la UAB, y todos ellos miembros del CIBER-BBN, han demostrado que el fármaco actúa solamente sobre las células iniciadoras de metástasis a través de su interacción específica entre un péptido presente en la nanopartícula proteica que lo transporta y el receptor celular CXCR4 que se encuentra sobreexpresado en las células tumorales. Esto permite atacar solamente a las células tumorales, bloqueando su diseminación en estadios tempranos, de manera que previene la aparición de metástasis a la vez que evita los efectos adversos derivados de los tratamientos habituales.
“Se ha observado que este receptor está sobreexpresado en 20 tipos diferentes de cáncer como mínimo, entre ellos los de próstata, mama, ovario y otros no tan comunes como el de páncreas” apuntan los investigadores. “Lo que significa que esta nanopartícula se puede dirigir para tratar diferentes tipos de neoplasias, convirtiéndola en un vehículo muy versátil que puede transportar diferentes moléculas terapéuticas de elevada potencia”, añaden.
Se trata del primer fármaco en el mundo que bloquea la diseminación metastásica, la principal causa de muerte en pacientes oncológicos
Actualmente, no existen fármacos en el mercado que eliminen selectivamente las células madre metastásicas. Por lo tanto, este nuevo descubrimiento podría tener un alto impacto clínico después de que se hayan realizado los ensayos necesarios para aplicarse en humanos. El Hospital de Sant Pau de Barcelona sería el primer centro en el mundo en evaluar este fármaco en humanos, previamente a su posible introducción en la terapéutica clínica.
Nanoligent, una nueva spin-off para financiar la nanopartícula
En junio de 2017 los investigadores del CIBER-BBN, el IIB Sant Pau y el Instituto de Biotecnología y Biomedicina de la UAB que firman ahora el artículo de EMBO Molecular Medicine pusieron en marcha Nanoligent, una spin-off creada para desarrollar el primer fármaco diseñado para eliminar las células metastásicas.
Esta empresa, que tiene más de 10 años de estudios a sus espaldas, está dirigida por Manuel Rodríguez Mariscal, profesional con una larga experiencia en el campo de la inversión y la creación de compañías biotecnológicas y tiene como objetivo conseguir la financiación para la realización del proyecto.
Artículo de referencia
Selective depletion of metastatic stem cells as therapy for human colorectal cancer. EMBO Molecular Medicine. María Virtudes Céspedes, Ugutz Unzueta, Anna Aviñó, Alberto Gallardo, Patricia Álamo, Rita Sala, Alejandro Sánchez‐Chardi, Isolda Casanova, María Antònia Mangues, Antonio Lopez‐Pousa,Ramón Eritja, Antonio Villaverde, Esther Vázquez, Ramón Mangues. DOI 10.15252/emmm.201708772
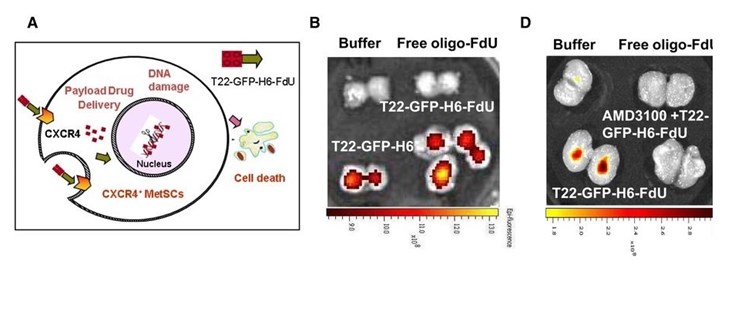
*Figura
A. Approach to achieve targeted drug delivery and selective killing of metastatic stem cells: CXCR4‐nanoconjugate interaction triggers CXCR4‐mediated internalization in MetSCs, in primary tumors and metastatic foci, followed by FdU release to the cytosol and diffusion to the nucleus to induce double‐strand breaks leading to selective killing of CXCR4+ cells.
B. Selective T22‐GFP‐H6‐FdU nanoconjugate biodistribution in subcutaneous CXCR4+ SW1417 CRC tumor tissue 5 h after a 100 μg single intravenous dose, as measured by fluorescence emission using IVIS Spectrum 200 (N = 5/group). Biodistribution is similar to that achieved by the T22‐GFP‐H6 targeting vector and undetectable after Buffer or free oligo‐FdU treatment (N = 5 mice/group).
D. Administration of the CXCR4 antagonist AMD3100 completely blocks T22‐GFP‐H6‐FdU tumor biodistribution, as measured by fluorescence emission. Fluorescence is not detected in Buffer or free oligo‐FdU controls (N = 5 tumor fields/group).